La Terra è un corpo celeste di modeste dimensioni. Se confrontata con altri astri o pianeti, è piuttosto piccola. Ciononostante è abbastanza grande da trattenere molecole gassose, fino a formare un involucro (più o meno) stabile, chiamato atmosfera. La sua composizione, alquanto eterogenea – a tal punto da poterla dire stratificata – è stata soggetta nel tempo a variazioni, alcune anche importanti. Con l’avvento e l’esplosione della tecnologia industriale, in particolare, il livello di ozono è stato seriamente compromesso, facendo scattare la sirena di un vero e proprio allarme ambientale.
Indice dell'articolo
Ozono e atmosfera
C’è qualcosa di invisibile, a cui neppure quasi mai badiamo, che ci pesa costantemente sulle spalle: l’aria. Questa coltre gassosa nella quale siamo immersi conosce un’estensione di circa 500km in altezza, ma si presenta assai incostante in quanto a densità e nella composizione chimica.
Nei primi 16km, in uno strato detto Troposfera, l’azoto e l’ossigeno la fanno da padroni, con l’acqua a controllare la temperatura bilanciando il servizio svolto dalla cappa di anidride carbonica. Questi elementi sono sempre più rarefatti man mano che ci si allontana dalla superficie terrestre.
Al di sopra troviamo la stratosfera, il cui fondo è caratterizzato dal più cospicuo addensamento di ozono ravvisabile nell’atmosfera tutta. Sebbene sia presente in parti per milione, l’ozono ha un compito cruciale da svolgere: bloccare i dannosi raggi ultravioletti, radiazioni solari a bassa lunghezza d’onda, mutagenici e quindi estremamente pericolosi.
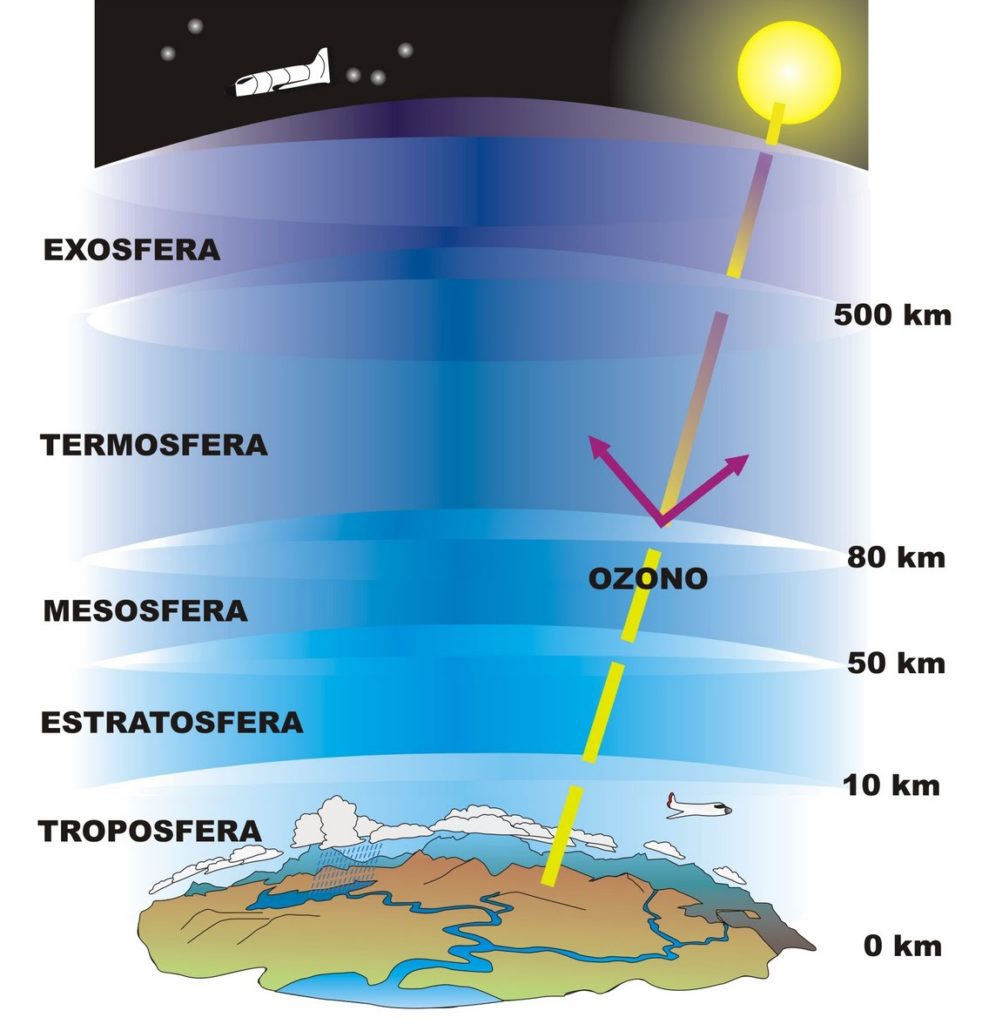
La scarsa accessibilità degli strati superiori rappresenta tutt’oggi una difficoltà insormontabile per gli scienziati, che descrivono la Mesosfera e la Termosfera solo in linea teorica grazie all’uso di calcoli matematici. Temperature estreme e rarefazione degli elementi in fase gassosa caratterizzano questi livelli atmosferici.
Che cos’è l’ozono?
Masticando un minimo di greco diventa facile prevedere il cattivo odore di questo instabile ma prezioso gas (ὄζειν è la forma all’infinito di un verbo traducibile con “puzzare”). Esplosivo allo stato liquido, esiste come ibrido di due strutture limite di risonanza in cui tre atomi di ossigeno si dispongono assumendo una geometria planare.
Chimicamente si comporta (ovviamente) da ossidante, e risulta tossico per la maggior parte delle forme di vita presenti sulla Terra. Essendo il risultato di una reazione endotermica tra molecole di ossigeno, la sua formazione richiede un elevato quantitativo di energia (come quella dei fulmini).
Il pull naturale è l’atmosfera, dove il processo avviene spontaneamente in entrambe le direzioni di reazione (l’ozono può a sua volta dare ossigeno). L’uomo però è anche in grado di produrlo industrialmente.
Perché l’ozono è tanto importante?
Dal punto di vista della Fisica ottica il Sole si comporta come un corpo nero, ed obbedisce alla legge di Wien, rilasciando energia sotto forma di radiazione luminosa in uno spettro quantificabile in base alla sua temperatura.
La luce è classificata in base alla sua stessa lunghezza d’onda. Lo spettro elettromagnetico inferiore – secondo questa scala – è detto UltraVioletto. Il nostro DNA non ci va particolarmente d’accordo, e l’esposizione prolungata può scatenare reazioni chimiche che portano all’insorgenza di mutazioni genetiche.
Il dimorfismo dei nucleotidi che formano l’acido nucleico tra le cui spire è scritto il nostro genoma è basato su molecole leggermente alcaline dette basi azotate. Tra queste distinguiamo due categorie: le purine, più ingombranti e complesse; e le più piccole pirimidine. Queste ultime diventano particolarmente reattive quando esposte ai raggi UV, stabilendo un legame che genera una struttura dimerica, unita in senso verticale.
Questo errore nel DNA viene spesso riparato grazie all’intervento della fotoliasi, ma talvolta può passare inosservato, e venire riprodotto durante i processi di duplicazione cellulare, in un meccanismo cancerogeno che riguarda per lo più le cellule cutanee.
A farci scudo da queste radiazione a bassa lunghezza d’onda interviene proprio il nostro ozono, bloccando i raggi UV sull’uscio della porta della stratosfera. Ecco perché questo gas risulta così importante per la vita sulla Terra.
Come si è bucato l’Ozono
In ogni storia che si rispetti dove c’è un eroe esiste anche un perfido antagonista. Il nostro si chiama clorofluorocarburo (CFC), una molecola usata negli spray e nei propellenti. La si ricava sinteticamente dal metano, attraverso la sostituzione degli atomi di idrogeno con degli alogeni.
Correva l’anno 1985 quando il British Antartic Atmosheric Survey annunciò pubblicamente un crollo delle concentrazioni di ozono stratosferico, geolocalizzandole al Polo Sud. Erano 15 anni di documentazioni, ritenute inizialmente un errore strumentale.
Un assottigliamento dello strato basale nel secondo livello dell’atmosfera – e quindi non un vero e proprio buco – fu sufficiente a far gridare al disastro ecologico. E a ben donde, visto che la diminuzione dell’1% di ozono stratosferico lascia passare il 2% di UV in più. Ciò si traduce in un aumento pari a un milione di casi di cancro alla cute ogni anno.
La portata di questo fenomeno è indice di quanto l’incedere della globalizzazione possa accelerare l’incedere ed aggravare l’incidere dei problemi ambientali. I prodotti contenenti CFC sono diffusi per lo più nei paesi industrializzati, ma i problemi che essi creano riguardano tutto il pianeta. Il movimento delle masse d’aria li spinge ai poli, dove si accumulano nei ghiacciai.
La calura estiva, provocando lo scioglimento degli iceberg, ne causa il rilascio massivo. Le molecole – piuttosto leggere – trovano asilo nell’ozonosfera, dove reagiscono con le molecole di O3, causandone la scissione ad ossigeno.
HCFC vs CFC: uno scontro per l’ambiente
La configurazione elettronica del Carbonio prevede quattro elettroni di valenza nel suo guscio più esterno. Quest’atomo è quindi tetravalente, potendo formare altrettanti legami.
In una molecola di CloroFluoroCarburo lo troviamo impegnato a intrattenere un legame con un atomo di Fluoro, e gli altri tre con dei Clori. Il CFC è molto instabile, in quanto gli alogeni sono piuttosto elettronegativi, e di sicuro lo sono molto di più del carbonio. L’energia solare pure ci mette del suo, cedendo energia sotto forma di calore.
Capita quindi che uno dei tre Clori si stacchi, lasciando il CFC al suo destino di carbocatione elettropositivo, e vada ad interagire con l’ozono. Questi cede facilmente un atomo al Cloro, e subito dopo ancora un altro. Al termine di questo breve ciclo, il Cloro rilascia ossigeno, e “attacca” una nuova molecola di ozono.
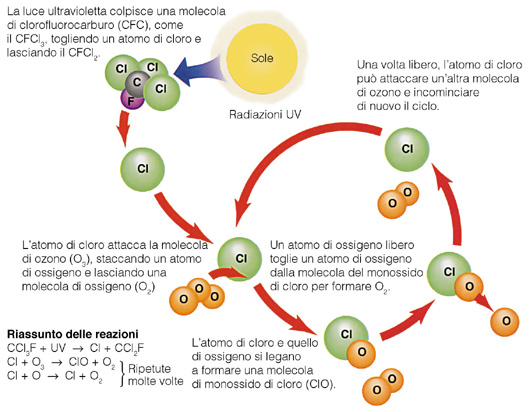
Nella conferenza tenutasi ad Helsinki nel 1989 per discutere di problematiche ambientali, i paesi partecipanti si impegnarono a limitare allo stretto indispensabile l’impiego di CFC. A questo furono preferiti HCFC (IdroCloroFluoroCarburi) e HFC (IdroFluoroCarburi), varianti con meno Cloro (in favore di Idrogeno), più stabili e quindi sicuri.
Dopo un danno che nel 1998 fu stimato essere di circa il 10%, la situazione sembra essersi stabilizzata. Occorre monitorare l’atmosfera con precisione e continuità, ponendosi l’obiettivo dell’ecosostenibilità come missione collettiva.
Lorenzo Di Meglio
Bibliografia su ozono e atmosfera
William H. Brown et al. – Chimica Organica – EdiSes
A. Provini et al. – Ecologia Applicata – CittàStudiEdizioni

