Indice dell'articolo
Edaravone: una speranza per i malati di SLA
L’Edaravone (inizialmente chiamato MCI-186, e poi distribuito con i nomi commerciali Radicut e Radicava) è una molecola sviluppata in Giappone nel 2015 per la terapia farmacologica della SLA, che attualmente si basa esclusivamente sul riluzolo.
Questo farmaco rappresenta un potenziale passo avanti nel trattamento di una patologia che attualmente resta purtroppo incurabile e dalla prognosi infausta nella maggior parte dei casi.
Tuttavia l’iter di approvazione dell’edaravone in Europa ha avuto un arresto in attesa di un ulteriore trial clinico che ne dimostri l’efficacia. In Italia però le cose sono andate diversamente, ma andiamo con ordine.
La SLA (sclerosi laterale amiotrofica)
Decorso clinico e fisiopatologia
La SLA è una patologia neurodegenerativa progressiva e invalidante che porta a una inesorabile paralisi muscolare di tutti i distretti corporei, ad eccezione dei muscoli oculari. È un tipo particolare di malattia del motoneurone, ovvero una patologia che colpisce i neuroni responsabili del movimento dei muscoli.
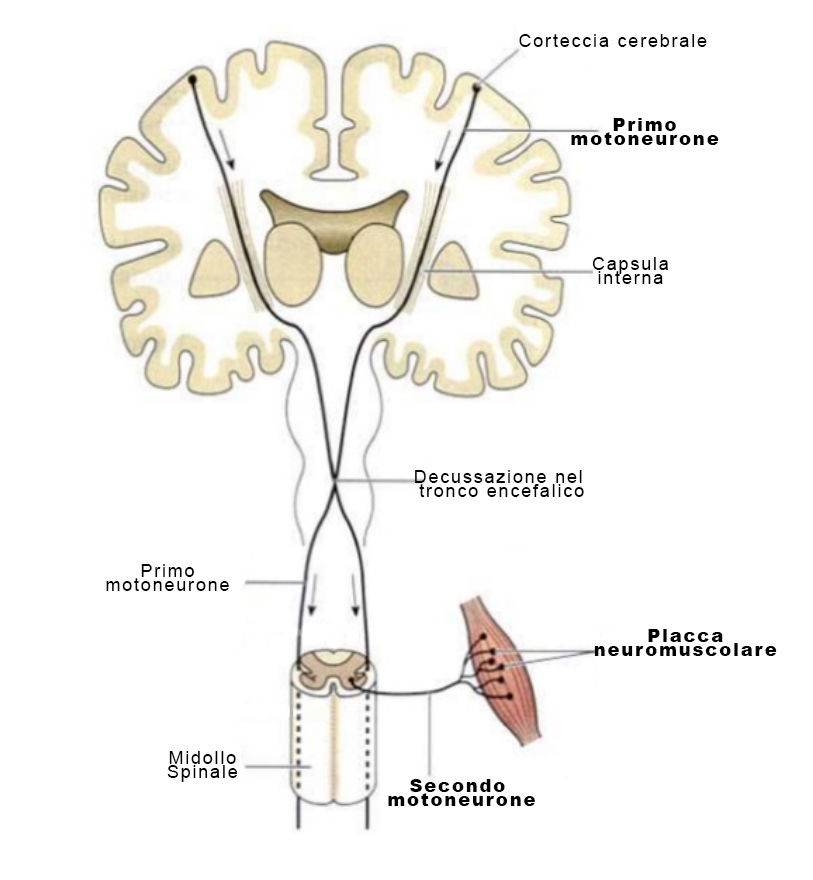
Il cosiddetto “sistema piramidale” è una catena neuronale che permette all’impulso elettrico di partire dalla corteccia cerebrale e di giungere alla placca neuromuscolare per attivare la contrazione del muscolo. Il sistema si basa su due motoneuroni: il primo motoneurone che va dalla corteccia al midollo spinale (o al tronco encefalico) e il secondo motoneurone che va dal midollo (o dal tronco) ai muscoli.
La SLA è caratterizzata dalla degenerazione di entrambi i motoneuroni in diverse regioni corporee, portando gradualmente alla tetraplegia e, come esito fatale, all’insufficienza respiratoria.
I meccanismi patologici
Attualmente i meccanismi biologici e biochimici della degenerazione dei motoneuroni non sono chiariti, ma alcuni studi hanno permesso di avanzare delle ipotesi.
Le forme familiari di SLA innanzitutto sono causate da mutazioni di alcuni geni, tra cui quello dell’enzima SOD1 (superossido dismutasi) e delle proteine TDP-43 e C9orf72. Le mutazioni di questi ultimi due geni causano una forma di SLA con demenza frontotemporale.
Le forme sporadiche invece sono state associate a storie di traumatismi cranici ripetuti (es. sportivi) e al consumo di alimenti fortemente ossidanti (semi di Cycas nell’isola di Guam).
Queste evidenze permettono di indiziare lo stress ossidativo (mutazioni SOD1, traumatismi e mutazioni TDP-43) e i danni del traffico vescicolare (C9orf72) come responsabili, almeno in parte, della degenerazione dei motoneuroni. Tuttavia le conoscenza attualmente disponibili non permettono di formulare teorie esaustive.
Come funziona l’Edaravone
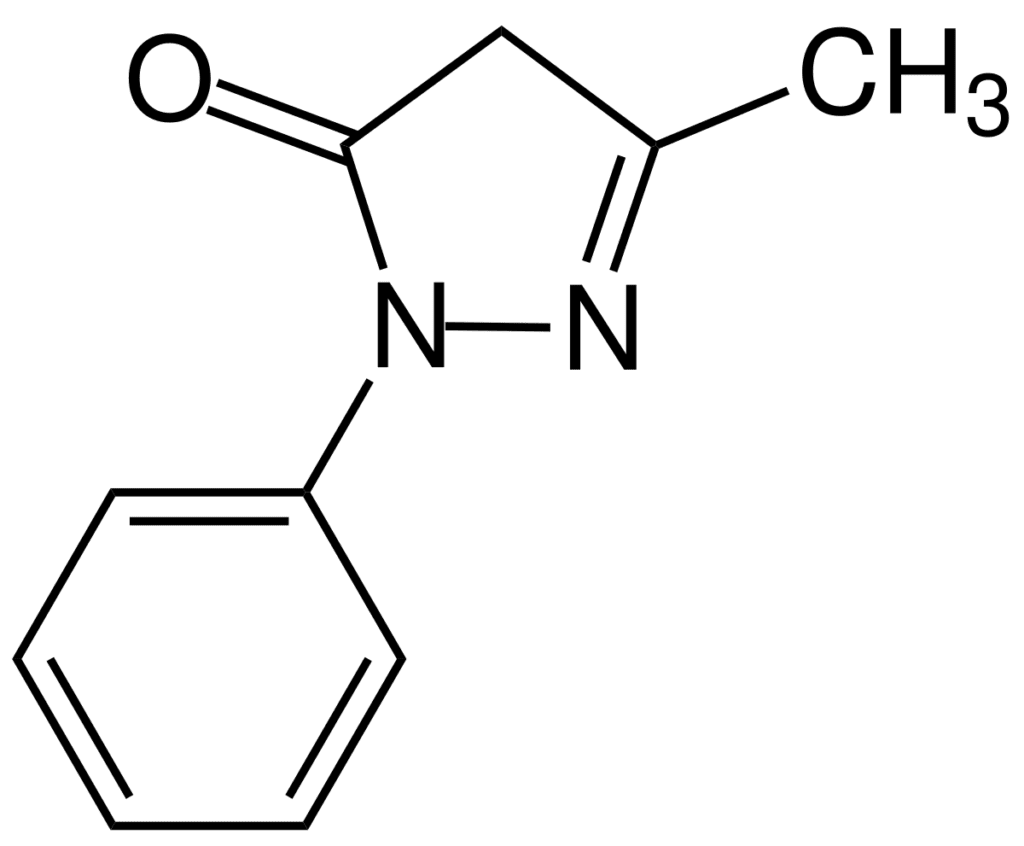
L’edaravone è una piccola molecola con buona idro- e lipo-solubilità, caratteristica che gli permette di attraversare agilmente la barriera emato-encefalica e quindi di entrare nel sistema nervoso centrale.
Si sostiene che l’azione principale del farmaco sia quella di “neutralizzare” i radicali liberi dell’ossigeno, composti chimici dannosi che provocano stress ossidativo e morte cellulare. Questa azione di scavenger proteggerebbe i neuroni dal danno cronico che conduce progressivamente alla degenerazione.
L’edaravone viene somministrato per via endovenosa in cicli di 28 giorni. Il paziente riceve la terapia per 14 giorni consecutivi, seguiti da un periodo senza trattamento di due settimane; quindi vi sarà un’infusione per 10 dei 14 giorni successivi, seguita da un periodo senza trattamento di due settimane.
I dati di efficacia dell’Edaravone
L’approvazione dell’edaravone da parte della Food and Drug Administration (l’agenzia regolatrice americana) si è basata sui risultati di uno studio clinico in doppio cieco, randomizzato, controllato verso placebo di Fase 3, che ha valutato l’efficacia e la sicurezza dell’edaravone nel trattamento della SLA. I risultati di questo studio sono stati poi pubblicati sulla prestigiosa rivista scientifica The Lancet Neurology.
Tale studio ha coinvolto 137 partecipanti con determinate caratteristiche cliniche: un punteggio di almeno 2 punti della scala ALSFRS-R; capacità vitale forzata pari o superiore all’80%; SLA “definita” o “probabile” secondo i criteri El Escorial; durata della malattia inferiore ai 2 anni.
I candidati sono stati divisi in due gruppi: un gruppo ha ricevuto 60 mg di edaravone endovena, mentre al secondo gruppo è stato somministrato un placebo.
Dopo sei mesi di trattamento, coloro che hanno ricevuto edaravone hanno avuto un 33% in meno nel punteggio ALSFRS-R (scala di valutazione della disabilità nella SLA) rispetto a quelli nel gruppo placebo.
Tale risultato è stato considerato statisticamente significativo e si è finalmente concluso che il farmaco fosse in grado di ridurre significativamente la progressione della disabilità nei pazienti affetti da SLA in fase iniziale.
L’approvazione in Europa e in Italia
Nel luglio 2017 AIFA, l’Agenzia Italiana del Farmaco (AIFA), ha accolto la domanda di inserimento dell’edaravone per pazienti con durata di malattia inferiore a 2 anni, buona funzionalità respiratoria e motoria. Successivamente nel 2018 l’AIFA ha approvato la somministrazione anche con durata di malattia superiore ai due anni.
Nel 2019, tuttavia, il Comitato per i medicinali per uso umano dell’Agenzia Europea del Farmaco (EMA) ha richiesto un ulteriore studio di sopravvivenza a lungo termine di almeno 12 mesi per completare il set di dati necessari per l’approvazione nell’Unione Europea.
Per questo motivo, nell’estate 2019 l’azienda giapponese produttrice del farmaco, la Mitsubishi Tanabe Pharma (MTPA), ha annunciato di aver ritirato la domanda di commercializzazione europea per l’edaravone.
Tuttavia nel maggio 2019 in Italia l’AIFA, su richiesta di AiSLA Onlus, ha deciso di prorogare per altri 12 mesi l’inserimento dell’edaravone nella lista dei farmaci a carico del Sistema Sanitario Nazionale.
Nell’autunno 2019, la MTPA ha annunciato l’apertura di un nuovo studio clinico di Fase 3 per valutare la sicurezza e l’efficacia di una formulazione orale di edaravone. Lo studio sta reclutando fino a 150 partecipanti e il suo completamento è previsto per giugno 2021.
Conclusioni
L’edaravone sembra avere dunque una certa efficacia nel rallentare moderatamente la disabilità nei pazienti con SLA in fase iniziale. Per cui, insieme al riluzolo, va a comporre l’armamentario farmaceutico contro questa grave patologia.
Tuttavia bisogna essere cauti e attendere maggiori dati a lungo termine per una migliore valutazione della sua efficacia e sicurezza.
Il futuro si prospetta ricco di possibili ausili per migliorare la qualità della vita dei pazienti con malattie neurodegenerative, grazie al lavoro incessante di medici, biologi e altri ricercatori del settore sanitario, ma anche grazie allo sviluppo di nuove tecnologie come protesi robotiche ed esoscheletri.
Bibliografia
Barone P., Brunetti A., Cappabianca P., Filla A., Gangemi M., Maiuri F., Santoro L., Spaziante R., Sistema nervoso – Neurologia – Neurochirurgia – Neuroradiologia, Napoli, Idelson – Gnocchi, 2012.
Fonti
Edaravone
https://clinicaltrials.gov/ct2/show/results/NCT01492686?term=edaravone&cond=Amyotrophic+Lateral+Sclerosis&rank=4&view=results
https://www.thelancet.com/journals/laneur/article/PIIS1474-4422(17)30115-1/fulltext
https://clinicaltrials.gov/ct2/show/NCT04165824
https://www.drugbank.ca/drugs/DB12243
https://www.osservatoriomalattierare.it/sla/13629-sla-aifa-rinnova-l-autorizzazione-alla-somministrazione-dell-edaravone
ATTENZIONE: Le informazioni contenute in questo sito hanno puramente scopo informativo e divulgativo. Questi articoli non sono sufficienti a porre diagnosi e decisioni di trattamento e non sostituiscono mai il parere del medico. Per ulteriori informazioni contattare il proprio medico generico o specialista.

